Com os avanços tecnológicos e as mudanças nas práticas de saúde, uma nova forma de condução dos estudos clínicos tem emergido: os ensaios clínicos descentralizados (DCTs).
Os DCTs oferecem uma abordagem inovadora para a pesquisa médica, usando tecnologias digitais para monitoramento remoto, recrutamento de pacientes em diversas localizações geográficas e coleta de dados em tempo real. Isso tem trazido uma transformação significativa para a forma como conduzimos as fases tradicionais dos estudos clínicos.
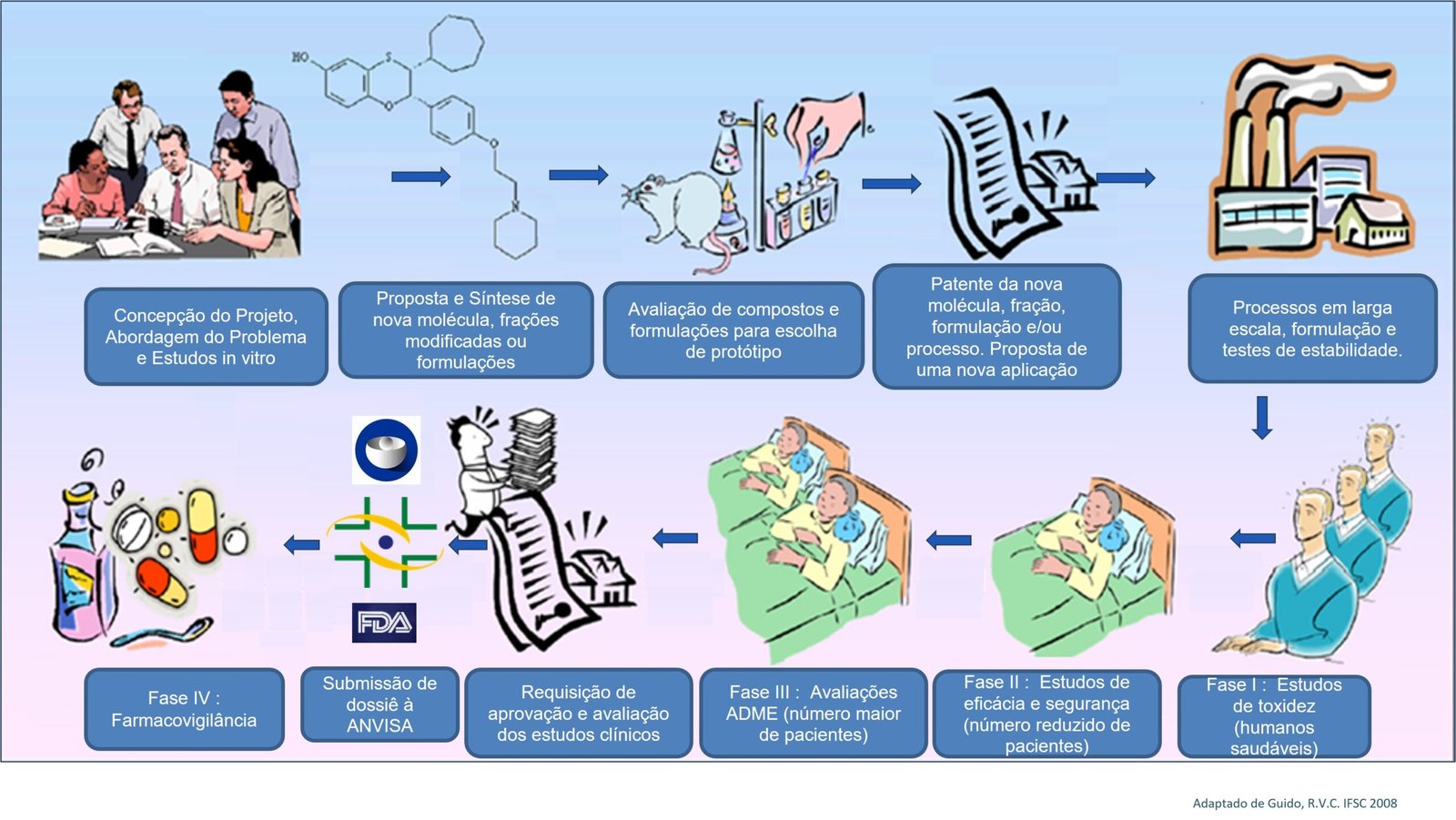
Os estudos clínicos são fundamentais para o desenvolvimento de novos tratamentos, vacinas e intervenções médicas. Eles são cuidadosamente planejados e divididos em fases, cada uma com objetivos específicos, desde a avaliação inicial de segurança até a comprovação de eficácia em larga escala.
As Fases dos Estudos Clínicos
Os estudos clínicos são geralmente divididos em quatro fases principais, cada uma representando uma etapa específica no desenvolvimento e teste de um tratamento:
Fase 1: Avaliação de Segurança
A primeira fase envolve um pequeno número de voluntários saudáveis ou pacientes (geralmente entre 20 e 100) e tem como objetivo principal avaliar a segurança de um novo tratamento ou droga. Nessa fase, os pesquisadores focam em identificar efeitos adversos, determinar a dose segura e compreender como o medicamento é metabolizado no corpo.
– Impacto dos DCTs: A fase 1 pode ser beneficiada por DCTs, especialmente com o uso de tecnologia para monitoramento remoto de sinais vitais, permitindo uma avaliação precisa dos efeitos adversos em tempo real sem a necessidade de hospitalizações frequentes.
Fase 2: Avaliação de Eficácia
Nesta fase, um grupo maior de pacientes (cerca de 100 a 300) recebe o tratamento. O objetivo é verificar se o medicamento ou intervenção é eficaz para tratar uma condição específica. Além disso, os pesquisadores continuam a monitorar a segurança do tratamento e procuram determinar a dose ideal.
– Impacto dos DCTs: Os DCTs podem agilizar o recrutamento de pacientes nessa fase, permitindo que participantes de várias regiões geográficas se inscrevam. O uso de dispositivos digitais e aplicativos de saúde para coletar dados pode aumentar a precisão da análise de eficácia.
Fase 3: Comparação com Tratamento Padrão
Já a fase 3 envolve um número ainda maior de pacientes (geralmente milhares) e tem como objetivo comparar o novo tratamento com o tratamento padrão para a doença em questão. Os pesquisadores buscam confirmar a eficácia, monitorar efeitos adversos e coletar informações que permitirão a comercialização do produto.
– Impacto dos DCTs: Com a tecnologia dos ensaios descentralizados, os estudos de fase 3 podem ser conduzidos em larga escala com maior eficiência, reduzindo o tempo necessário para o recrutamento e aumentando a retenção de participantes. Isso também proporciona maior diversidade no estudo, uma vez que pacientes de diferentes regiões, grupos etários e perfis socioeconômicos podem participar sem a necessidade de deslocamento físico constante.
Fase 4: Pós-Comercialização
Após a aprovação de um medicamento pelas agências reguladoras, a fase 4 foca no acompanhamento de longo prazo, avaliando a segurança do medicamento pós comercialização, etapa chamada de Farmacovigilância. Aqui, os pesquisadores observam o desempenho do tratamento em uma população maior para monitorar efeitos colaterais raros ou a longo prazo.
– Impacto dos DCTs: A coleta de dados em tempo real através de dispositivos móveis e aplicativos de saúde pode fornecer uma visão contínua sobre a segurança e eficácia do tratamento pós-comercialização, facilitando o cumprimento das exigências regulatórias.

Inovação em Saúde e o Impacto dos Ensaios Clínicos Descentralizados
A Evolução dos Ensaios Clínicos Descentralizados (DCTs)
Os ensaios clínicos descentralizados têm revolucionado a pesquisa médica, especialmente no contexto da pandemia de COVID-19, que acelerou a adoção de abordagens virtuais para manter os estudos em andamento. Os DCTs utilizam plataformas digitais para gerenciar vários aspectos dos estudos, desde o recrutamento até o monitoramento e coleta de dados, permitindo que os participantes se envolvam a partir de suas casas ou de locais mais acessíveis.
Vantagens dos DCTs
- Maior acesso e inclusão: Com os DCTs, é possível envolver pacientes de áreas remotas ou de diferentes grupos demográficos que, de outra forma, seriam excluídos devido a limitações geográficas.
- Redução de custos e maior eficiência: A logística associada ao transporte de pacientes e à necessidade de consultas presenciais pode ser eliminada ou reduzida.
- Retenção de pacientes: A flexibilidade proporcionada pelos DCTs resulta em taxas mais baixas de abandono dos estudos.
Desafios dos DCTs
- Conformidade regulatória e segurança de dados: A proteção de dados dos participantes, especialmente em conformidade com regulamentos como a LGPD e o GDPR, é uma questão crítica.
- Padronização global: Ainda há uma falta de harmonização completa entre as regulamentações de diferentes países para a realização de DCTs, o que pode representar desafios para estudos multicêntricos.
Harmonizações Internacionais: ICH Guides
Os guias de boas práticas clínicas são padronizados internacionalmente pela International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). O guia ICH E6(R2) é o mais amplamente utilizado e oferece diretrizes sobre como conduzir estudos clínicos de forma ética e com qualidade, independentemente de serem tradicionais ou descentralizados.
Principais Pilares dos Guias ICH:
• Proteção dos direitos e segurança dos participantes.
• Garantia de dados confiáveis e resultados válidos.
• Documentação completa e robusta dos estudos clínicos.
Estudo de Caso:
Science 37 e o Impacto Global dos DCTs
A Science 37, uma empresa pioneira em ensaios clínicos descentralizados, conduziu um estudo multicêntrico de fase 3 sobre dermatite atópica. O objetivo era testar um novo medicamento em uma população globalmente distribuída, com coleta de dados digital e consultas remotas. Esse estudo contou com mais de 1.500 participantes distribuídos em cinco países.
Resultados:
• Tempo de recrutamento reduzido: Usando plataformas digitais para anúncios e recrutamento, o tempo necessário para preencher as vagas de participantes foi reduzido em 40% em comparação aos métodos tradicionais.
• Engajamento superior: Mais de 90% dos participantes completaram o estudo, um número significativamente maior que a média dos ensaios clínicos tradicionais.
• Diversidade geográfica e demográfica: O estudo conseguiu englobar uma amostra mais representativa da população global, superando uma das principais limitações dos ensaios convencionais.
Este estudo exemplifica como os DCTs estão mudando o cenário da pesquisa clínica, tornando o processo mais ágil, inclusivo e eficiente.
O Futuro dos Ensaios Clínicos Descentralizados
O futuro dos DCTs está fortemente ligado ao avanço da tecnologia, com inovações como inteligência artificial (IA) e machine learning sendo integradas para aprimorar a análise de dados e a seleção de pacientes. Além disso, o uso de blockchain para garantir a segurança e a imutabilidade dos dados dos participantes já está sendo explorado. Com o aumento do uso de dispositivos wearables, como smartwatches e monitores de glicose, a coleta de dados em tempo real será ainda mais precisa e contínua. Garantindo, dessa forma, uma vigilância ativa da saúde dos participantes durante todo o estudo.
Com o aumento do uso de dispositivos wearables, como smartwatches e monitores de glicose, a coleta de dados em tempo real será ainda mais precisa e contínua. Garantindo, dessa forma, uma vigilância ativa da saúde dos participantes durante todo o estudo.
Conclusão
Dessa forma, podemos dizer que os ensaios clínicos descentralizados já estão transformando a pesquisa médica de forma significativa em parceria com a IA. Desde a aceleração do recrutamento até a inclusão de populações antes sub-representadas, os DCTs têm mostrado seu valor em estudos de todas as fases. E assim, à medida que a tecnologia avança, espera-se que os DCTs se tornem ainda mais integrados e essenciais para o desenvolvimento de novos tratamentos, e aplicações. Alinhando-se às normas regulatórias globais e proporcionando mais segurança e eficiência em todas as etapas.
Referências Bibliográficas
FOOD AND DRUG ADMINISTRATION (FDA). Conducting Clinical Trials With Decentralized Elements. Silver Spring, MD: FDA, 2023. Disponível em: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/conducting-clinical-trials-decentralized-elements. Acesso em: 5 mar. 2025.
EUROPEAN MEDICINES AGENCY (EMA). Reflection Paper on Risk-Based Quality Management in Clinical Trials. Amsterdam: EMA, 2013. Disponível em: https://www.ema.europa.eu/en/documents/scientific-guideline/reflection-paper-risk-based-quality-management-clinical-trials_en.pdf. Acesso em: 5 mar. 2025.
INTERNATIONAL COUNCIL FOR HARMONISATION (ICH). E6(R2) Good Clinical Practice: Integrated Addendum to ICH E6(R1). Genebra: ICH, 2016. Disponível em: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/e6r2-good-clinical-practice-integrated-addendum-ich-e6r1. Acesso em: 5 mar. 2025.
CLINICALTRIALS.GOV. Base de dados de ensaios clínicos registrados. Bethesda, MD: U.S. National Library of Medicine. Disponível em: https://clinicaltrials.gov/. Acesso em: 5 mar. 2025.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Resolução RDC nº 9, de 20 de fevereiro de 2015. Brasília, DF: ANVISA, 2015. Disponível em: https://www.in.gov.br/materia/-/asset_publisher/Kujrw0TZC2Mb/content/id/23070813/do1-2015-02-23-resolucao-rdc-n-9-de-20-de-fevereiro-de-2015-23070736. Acesso em: 5 mar. 2025.
SCIENCE 37. Ensaios Clínicos Descentralizados. Los Angeles, CA: Science 37, 2024. Disponível em: https://www.science37.com. Acesso em: 5 mar. 2025.
MEDABLE. Ensaios Clínicos Virtuais. Palo Alto, CA: Medable, 2024. Disponível em: https://www.medable.com. Acesso em: 5 mar. 2025.
IQVIA. Benefits of Virtual Clinical Trials. Durham, NC: IQVIA, 2024. Disponível em: https://www.iqvia.com. Acesso em: 5 mar. 2025.
DE JONG, Amos J.; et al. Opportunities and Challenges for Decentralized Clinical Trials: European Regulators’ Perspective. Clinical Pharmacology & Therapeutics, v. 112, n. 2, p. 344-352, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35488483/. Acesso em: 5 mar. 2025.